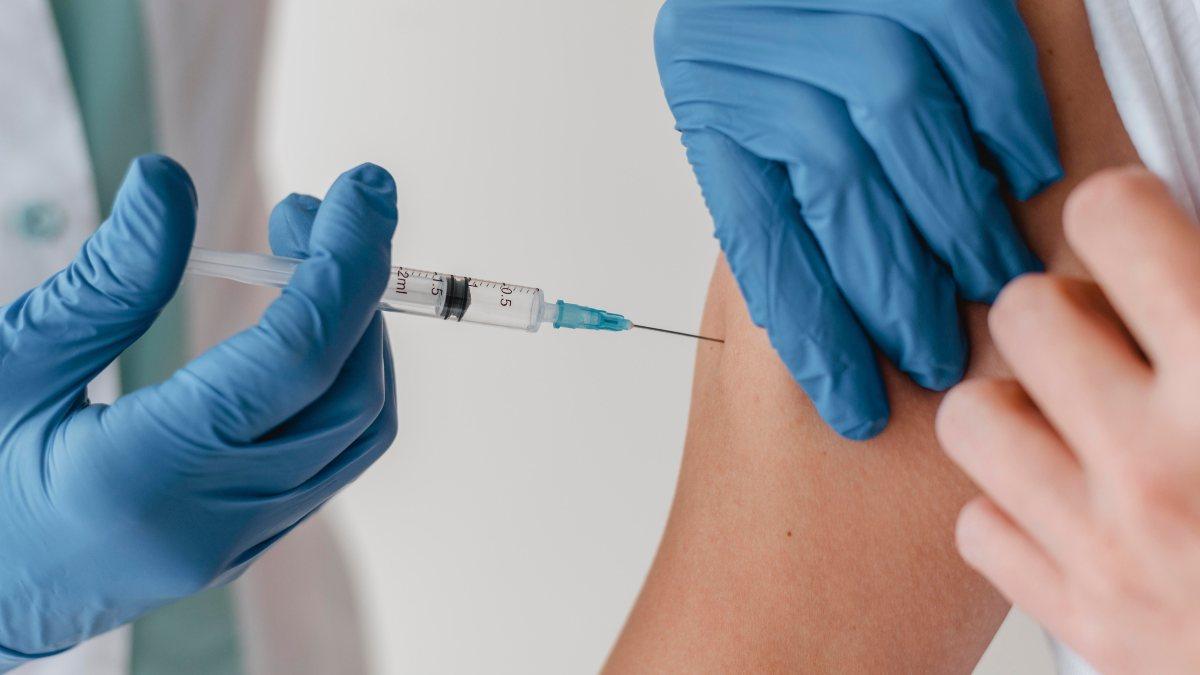
Nella lotta contro la minaccia globale dell’influenza aviaria, gli Stati Uniti hanno compiuto un passo importante investendo 176 milioni di dollari nello sviluppo di un nuovo vaccino.
Il nuovo vaccino, in fase di sviluppo da diverse aziende farmaceutiche, ha l’obiettivo di immunizzare pollame e altri volatili contro il virus H5N1, uno dei ceppi più aggressivi dell’influenza aviaria. L’investimento americano rappresenta un segnale forte della volontà di prevenire future pandemie e di salvaguardare la salute umana e animale.
L’impegno degli Stati Uniti nello sviluppo di un vaccino anti-aviaria è un passo fondamentale per la protezione della salute pubblica e la sicurezza alimentare.
Moderna ottiene 176 milioni di dollari per il vaccino mRNA contro l’influenza aviaria
Il Dipartimento della Salute e dei Servizi Umani degli Stati Uniti (HHS), tramite la sua Biomedical Advanced Research and Development Authority (BARDA), ha annunciato di aver assegnato a Moderna 176 milioni di dollari per sviluppare un vaccino pre-pandemico contro l’influenza aviaria H5.
L’HHS ha spiegato che questo finanziamento mira a migliorare la capacità del Paese di rispondere a un’eventuale pandemia influenzale, attualmente basata su tecnologie vaccinali tradizionali e datate. Moderna utilizzerà le sue avanzate piattaforme di produzione di vaccini mRNA, già utilizzate per i vaccini antinfluenzali stagionali.
Il finanziamento arriva in risposta all‘aumento dei casi di influenza aviaria H5N1 nei bovini e nel pollame negli Stati Uniti.
Dawn O’Connell, assistente segretaria per la preparazione e la risposta presso l’HHS, ha dichiarato che i 176 milioni di dollari rappresentano solo la base del finanziamento. L’accordo prevede ulteriori opzioni per finanziare rapidamente lo sviluppo di altri vaccini mRNA in caso di emergenza di nuovi ceppi influenzali o altre minacce sanitarie. Il vaccino H5 è attualmente in fase di sviluppo clinico, con le sperimentazioni di fase 3 previste per il 2025.
Cosa prevede l’accordo tra governo americano e Moderna
L’accordo include anche un’opzione per la produzione su larga scala del vaccino in caso di pandemia. Robert Johnson, direttore delle contromisure mediche presso BARDA, ha affermato che è presto per fare previsioni precise sulla capacità produttiva, che dipenderà dai dati sul dosaggio attesi entro fine anno.
Moderna ha avviato una sperimentazione clinica di fase 1/2 di un vaccino sperimentale contro l’influenza pandemica su adulti sani, che include candidati contro i virus H5 e H7, con i risultati attesi entro l’anno.
Nel frattempo, continua la produzione e il confezionamento del vaccino candidato H5 adiuvato a base di cellule prodotto da CSL Seqirus. O’Connell ha dichiarato che la prima delle 4,8 milioni di dosi sarà disponibile a metà luglio, con la produzione che continuerà fino ad agosto, in anticipo rispetto alle previsioni del governo.
Uso precoce del vaccino anti-aviaria per le persone a rischio
I funzionari federali stanno valutando l’uso anticipato del vaccino per proteggere i lavoratori agricoli e altre persone a rischio di esposizione al bestiame infetto.
Nirav Shah, vicedirettore principale dei CDC, ha indicato che per prevenire la trasmissione del virus, l’uso di farmaci antivirali potrebbe essere più rapido ed efficace rispetto al vaccino. I funzionari stanno valutando i rischi e i benefici e considerando se le persone esposte al bestiame accetteranno di ricevere il vaccino.
Finora, oltre 780 persone esposte al bestiame sono state monitorate, e almeno 53 con sintomi influenzali sono state testate per il virus H5. Attualmente, sono state confermate tre infezioni umane legate alle mucche da latte. Shah ha sottolineato che ci sono 750.000 test disponibili per il virus H5, con altri 1,2 milioni che saranno disponibili nei prossimi mesi.
Vi terremo aggiornati sugli sviluppi riguardanti questo vaccino e quando potrebbe esserci la possibilità di averlo anche in Europa.